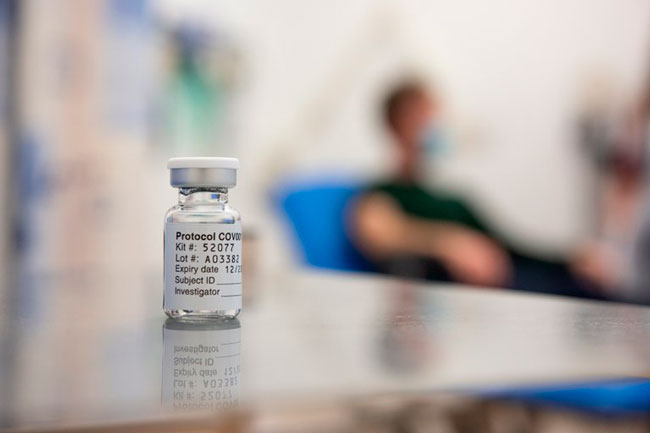
La aprobación de la fórmula, que es más barata y requiere un menor esfuerzo logístico para su traslado y conservación es una muy buena noticia para América Latina. Hace horas también recibió la aprobación de la agencia regulatoria argentina, Anmat, para uso de emergencia
Ciudad de México (Infobae).- La aprobación bajo uso de emergencia de la vacuna AZD1222 contra el COVID-19 tal como adelantara Infobae producida por el binomio científico conformado por la Universidad de Oxford y el laboratorio AstraZeneca por parte de la Agencia Reguladora de Medicamentos y Productos Sanitarios del Reino Unido (MHRA, según sus siglas en inglés) podría cambiar el curso de la pandemia en la región para siempre.
La ola positiva de este hallazgo científico desde Oxford -fue el primer desarrollo de vacunas contra el SARS-COV-2 que se inició en el mundo luego de que estallara la pandemia global- para América Latina está basada en un potente pentágono científico: mejor acceso, mejor precio, mejor conservación, mejor almacenamiento y mejor administración de las dosis.
El tipo de tecnología que posee esta vacuna (adenovirus en este caso de chimpancé) y su lógica de producción de origen y aplicación de las dosis la convierte en un desarrollo accesible por el concepto Non profit que desde el comienzo de la pandemia plantearon los investigadores de Oxford alrededor del hallazgo científico y de la escala de producción a través de las distintas asociaciones con hubs biotecnológicos, como el argentino mAbxcience (del Grupo Insud) y desde México, el Grupo Slim.
La autorización que hoy brindó la agencia regulatoria inglesa (MHRA) estableció el suministro de emergencia de la vacuna contra el COVID-19 de Oxford-AstraZeneca para la inmunización activa de personas mayores de 18 años. La autorización recomienda dos dosis administradas con un intervalo de entre 4 y 12 semanas. En los ensayos clínicos de Fase III se demostró que este régimen es seguro y eficaz para prevenir el COVID-19 sintomático, sin casos graves ni hospitalizaciones más de 14 días después de la segunda dosis.
El insumo fundamental de esta vacuna será producido en la Argentina -a través de mAbxience- y el empaquetado y distribución regional se realizará desde México. Este diseño del proyecto científico de escala global-regional-local le confiere características que la presenta como una vacuna conveniente para los países emergentes por tener mejor acceso y precio, mejor administración de las dosis y mejor transporte ya que puede almacenarse durante largos períodos a temperaturas normales de refrigeración.
Piso de inmunidad
El tema alrededor de las dosis es muy relevante porque según revelaron en exclusiva a Infobae los investigadores de Oxford con la primera dosis se accede al 70% de la inmunidad y con la segunda -que se completará entre las 4 y 12 semanas subsiguientes – se completa el 90% de la eficacia, reforzando la memoria del sistema inmunitario para proteger al individuo contra el virus SARS-COV- 2 y la enfermedad que este provoca, COVID-19.
Justamente en la búsqueda del sello de aprobación y durante el proceso de rolling review (revisión continua) que esta vacuna de Oxford-AstraZeneca transitó en los últimos meses desde la culminación exitosa de su Fase III, los reguladores se encontraron frente al dilema de las diferencias en las tasas de eficacia de la vacuna. Para lograr la primera aprobación de esta mañana por parte de la MHRA fue sustancial un estudio publicado esta semana que sugirió que dejar un espacio adecuado entre dosis es la forma más crucial de aumentar la eficacia.
El caso argentino puede resultar emblemático para el resto de los países de la región: Argentina a través de un convenio de compra anticipada firmado en noviembre pasado entre el Gobierno Nacional y el laboratorio AstraZeneca reservó 22.4 millones de dosis de esta vacuna y la compañía globalmente prevé producir una primera tanda non profit de 3 mil millones de dosis. Ahora la vacuna aguarda la inminente aprobación de las dos agencias regulatorias más importantes del mundo, la norteamericana FDA y la europea EMA. Y hace horas también recibió la aprobación de la agencia local argentina ANMAT, a la cual el laboratorio AstraZeneca ya le había presentado toda la documentación respaldatoria correspondiente.
Ventaja comparativa
La aprobación de la vacuna de Oxford-AstraZeneca permitió liberar las primeras dosis hoy miércoles para que puedan comenzar a administrase a principios del año nuevo en Inglaterra; y luego si la asociación Oxford-AstraZeneca con los locales mAbxience-Insud y el regional Slim funciona en tiempo y forma, en marzo 2021 América Latina podrá comenzar a vacunas a sus habitantes, dejando en evidencia que si bien la aprobación bajo uso de emergencia tiene las mismas características que la que recibió la vacuna de Pfizer-Biontech, el hecho de la producción regional a escala dispara ventajas comparativas para la región.
Argentina y México anunciaron con entusiasmo el acuerdo para producir la prometedora vacuna basada en adenovirus de chimpancé – una tecnología similar a la que utilizó el Instituto ruso Gamaleya para producir la Sputnik V , solo que con dos adenovirus-, lo que significa que esta aprobación abrió la llave para una candidata con posibilidades de producción local. Según las proyecciones ambos países podrían producir entre 150 y 250 millones de dosis iniciales. El laboratorio argentino encargado de llevar la importante tarea es el de mAbxience, una compañía biotecnológica internacional, especializada en la investigación, desarrollo y fabricación de anticuerpos monoclonales, parte del grupo farmacéutico Insud Pharma. El acuerdo se complementa con el aporte de la Fundación de Carlos Slim que financia una primera parte del proyecto.
Justamente para perfilar el debate científico sobre esta vacuna, el director ejecutivo del laboratorio AstraZeneca, Pascal Soriot explicó en declaraciones a las que tuvo acceso Infobae que, “se ha demostrado que esta vacuna es eficaz, bien tolerada, sencilla de administrar y AstraZeneca lo suministra sin ánimo de lucro (non profit). Nos gustaría agradecer a nuestros numerosos colegas de AstraZeneca, la Universidad de Oxford, el gobierno del Reino Unido y las decenas de miles de voluntarios de los ensayos clínicos ”
Y el profesor Andrew Pollard, director del Grupo de Vacunas de Oxford e investigador jefe del Ensayo de Vacunas de Oxford, dijo: “La evaluación del agente regulador (la agencia inglesa NHRA) aseguró que esta es una vacuna segura y efectiva y se trata de un momento histórico. Es el respaldo al enorme esfuerzo de un equipo internacional dedicado de investigadores y nuestros participantes dedicados al ensayo. Aunque esto es solo el comienzo, comenzaremos a adelantarnos a la pandemia, a proteger la salud y la economía cuando los vulnerables sean vacunados en todas partes, tantos como sea posible lo antes posible “.
Según reveló el diario The Telegraph, la vacuna Oxford se comenzará a aplicar a partir del 4 de enero, de acuerdo a los planes que están elaborando los ministros, quienes esperan dar con esta decisión un golpe importante en el aumento del programa de inoculación en todo el país.
La ansiedad por lograr su aprobación llega en un momento donde las cifras de contagios tocan los récords, pero en especial cuando los últimos anuncios sobre mutaciones del Sars-Cov-2 han puesto en estado de alarma a todo el país, y han generado que el Reino Unido quede prácticamente aislado debido al temor a la propagación de estas nuevas variantes. Según las últimas cifras oficiales, los contagios en territorio británico han aumentado en un 61,2 % en los últimos siete días, respecto a los siete previos.
Este inoculante se considera vital para los países de bajos ingresos y los de clima cálido porque es más barata, más fácil de transportar y puede almacenarse durante largos períodos a temperaturas normales de refrigeración.
Los datos de las pruebas de última etapa de AstraZeneca en el Reino Unido y Brasil publicados en noviembre mostraron que la vacuna tenía una eficacia del 62% para los participantes del ensayo que recibieron dos dosis completas, pero del 90% para un subgrupo más pequeño al que se le dio la mitad y luego una dosis completa. Los resultados publicados en la revista The Lancet convirtieron a la vacuna desarrollada por AstraZeneca y la Universidad de Oxford en la primera en proporcionar evidencia preliminar que logra detener el SARS-CoV-2, y fundamentalmente, sugirieron que podría ser la única en evitar la propagación de la enfermedad.
Si bien estos hallazgos hicieron que los reguladores se encontraran frente al dilema de las diferencias en las tasas de eficacia de la vacuna, un estudio publicado esta semana, y que fue sustancial en el proceso de rolling review en manos de la Agencia Reguladora de Medicinas y Cuidado de la Salud del Reino Unido (MHRA, por sus siglas en inglés), sugerió que dejar un espacio adecuado entre dosis es la forma más crucial de aumentar la eficacia.
¿Cómo funciona la vacuna? El virus SARS-CoV-2 está repleto de proteínas que utiliza para ingresar a las células humanas. Estas proteínas, denominadas proteínas de pico, son un objetivo tentador para posibles vacunas y tratamientos. La vacuna Oxford-AstraZeneca se basa en las instrucciones genéticas del virus para construir la proteína de pico. Pero a diferencia de las vacunas Pfizer-BioNTech y Moderna, que almacenan las instrucciones en ARN monocatenario, la vacuna Oxford utiliza ADN bicatenario.
Los investigadores agregaron el gen de la proteína de pico de coronavirus a otro virus llamado adenovirus. Los adenovirus son virus comunes que generalmente causan resfriados o síntomas similares a los de la gripe. El equipo de Oxford-AstraZeneca utilizó una versión modificada de un adenovirus de chimpancé, conocido como ChAdOx1, que puede ingresar a las células, pero no puede replicarse dentro de ellas.
AZD1222 surgió de décadas de investigación sobre vacunas basadas en adenovirus. En julio, se aprobó la primera para uso general: una vacuna contra el ébola, fabricada por Johnson & Johnson. Y se continúa -en los huecos que deja la jerarquía que ocupó la investigación sobre el COVID-19- con la realización de los ensayos clínicos avanzados para otras enfermedades, como el VIH y el Zika.
Para los investigadores de Oxford según consignaron a Infobae, la vacuna Oxford-AstraZeneca para el COVID-19 es más resistente que las vacunas de ARNmensajero de Pfizer y Moderna. El ADN no es tan frágil como el ARN, y la capa de proteína resistente del adenovirus ayuda a proteger el material genético en su interior. Como resultado, la vacuna de Oxford no tiene que permanecer congelada. Se espera que la vacuna dure al menos seis meses cuando se refrigera a 38–46°F (2–8°C).
Para Soriot, el laboratorio AstraZeneca ha encontrado la “fórmula ganadora” para hacer que su vacuna contra el COVID-19 tenga una efectividad a la altura de las de Pfizer/BioNTech, del 95 %, y Moderna, del 94 %. “Creemos que hemos hallado la fórmula ganadora para alcanzar una efectividad que, tras dos dosis, sea tan alta como todas las demás”, explicó Soriot al dominical Sunday Times sobre el preparado que su compañía desarrolla junto a la universidad de Oxford. Según declaró Soriot, la vacuna asegura una “protección del 100%” contra las formas graves de COVID-19 , con un intervalo prolongado entre las dos dosis y sin perder inmunidad.